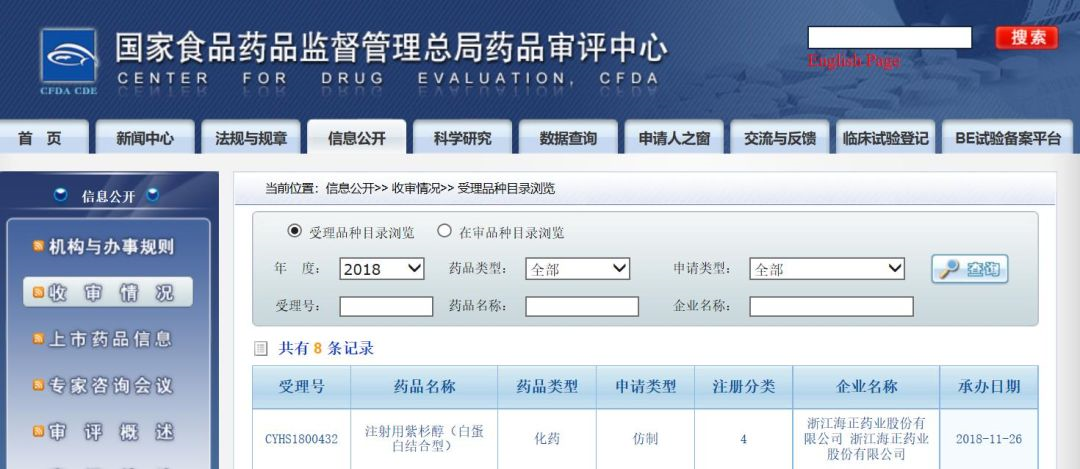
11月26日,CDE收审情况信息库发布数据,浙江海正药业股份有限公司的注射用紫杉醇(白蛋白结合型)的4类仿制药上市申请已获CDE受理。
在此之前,石药在同恒瑞的注射用紫杉醇(白蛋白结合型)首仿之争中胜出,成功于今年2月份获批,拿到首仿资格的同时也视同通过一致性评价,打破原研进口市场垄断;随后,9月份,恒瑞发布公告,注射用紫杉醇(白蛋白结合型)获得国家药监局批准,成为国产第二家注射用紫杉醇(白蛋白结合型)上市的公司。
业内人士指出,海正的仿制药产品上市,将令这一极具重磅潜力的抗癌药品种进入更加激烈的市场竞争阶段,尤其是对于仿制药一致性评价而言,前三家产品一旦涌现,有机会快速锁定临床用药格局,抢占进口原研品种市场,细分领域即将迎来严峻考验,价格的断崖式下跌或将无法避免。
“1+3”格局资源博弈
恒瑞和石药是国内最早申报注射用紫杉醇(白蛋白结合型)的两家企业,首次提交注册申请的时间相差不足1个月,而且两个品种分别在2016年10月和2017年3月被纳入优先审评,首仿之争战况激烈。
值得注意的是,二者申报路径存在区别,恒瑞的产品是在完成BE试验之后,按照老6类申报上市,石药则是在完成BE试验后直接按照新4类提交注册申请。然而,最终石药集团欧意药业超过了素有“研发一哥”称号的恒瑞,以“新注册分类4类”拔得注射用紫杉醇(白蛋白结合型)仿制头筹,纳入《中国上市药品目录集》。
白蛋白紫杉醇是一种抗微管药物,国家药监局批准用于治疗联合化疗失败的转移性乳腺癌或辅助化疗后6个月内复发的乳腺癌,FDA已经批准的适应症包括肺癌、乳腺癌、以及胰腺癌等。该药由美国Abraxis公司研发(后被Celgene收购),为优化改进剂型。
2017年9月28日,百济神州与Celgene达成肿瘤领域的全球战略合作,百济神州得以全面接手新基在中国的商业团队,并获得Abraxane(注射用紫杉醇白蛋白结合型)、Revlimid (来那度胺)和Vidaza(注射用阿扎胞苷)的中国商业化权利。
而在石药和恒瑞产品获批之后,白蛋白紫杉醇这一品种的市场竞争格局已经演绎成百济神州、石药集团、恒瑞医药“1家原研+2家仿制”的微妙市场局面。目前,该药品已经进入多个省份的医保目录,但主要市场份额依旧被原研进口产品占据,石药和恒瑞品种凭借原研价格五折的中标价快速切分市场蛋糕,海正作为仿制药后来者,产品上市将进一步搅动细分市场。
注射剂评价进程加速
随着药品审评审批制度改革的纵深推进,以全面提升仿制药质量,实现国产仿制药对原研药临床替代为核心目标的仿制药质量和疗效一致性评价正在不断取得阶段性进展。
标点信息米内网数据显示,从2018年5月开始,CDE承办的一致性评价申请受理号出现大幅度增长,截至10月15日,CDE承办的一致性评价申请受理号已达438个,涉及品种178个,其中在9月份承办的受理号高达79个,创历史新高。
从注射剂一致性评价申请情况看,438个一致性评价申请受理号中,有97个受理号属于注射剂,涉及品种45个,其中在9月份承办的受理号有26个,创历史新高,注射剂一致性评价即将步入爆发期。从注射剂一致性评价通过情况看,通过(含视同通过)一致性评价的注射剂品规有11个,涉及品种7个。
截至11月5日,通过或视同通过一致性评价的仿制药受理号有107个(涉及品种59个),其中有6个品规(涉及4个品种)属于抗肿瘤药,吉非替尼片、甲磺酸伊马替尼片、注射用紫杉醇(白蛋白结合型)及注射用培美曲塞二钠均通过或视同通过一致性评价。
如今,国内上市的紫杉醇品种主要有紫杉醇注射液、紫杉醇脂质体注射液、注射用紫杉醇(白蛋白结合型),其中紫杉醇注射液生产聚集厂家众多,双鹭、悦康、辰欣、扬子江、奥赛康等企业均有布局;紫杉醇脂质体注射液(力扑素)是绿叶独创的全球首个紫杉醇脂质体产品;白蛋白结合型仿制品种上市,将进一步改变临床用药习惯,分化传统市场渠道。
来源:医药经济报 张蓝飞